新加坡A水准考试是目前新加坡政府大学入学的资格考试,相当于我们的高考,新加坡的A水准课程有很多的科目,其中化学也是非常重要的一科。新加坡A水准化学也是分了H1、H2和H3三个等级,下面考而思惟世为大家详细介绍一下。
考试内容
试卷1(1小时,30分)
这份试卷由30道选择题组成。四至六个项目将是多重完成类型。所有问题将包括4个选项。
试卷2(2小时,80分)
本文由两部分组成。所有答案都将写在试卷上提供的空白处。
A部分(60分):包括可变数量的结构化问题,包括基于数据的问题,都是必修的。基于数据的问题占本试卷的15-20分。基于数据的问题提供了一个很好的机会来测试高阶思维技能,如处理、应用和评估信息。
B部分(20分):考生将被要求回答两个问题中的一个。每道题20分。这些问题将要求考生整合化学教学大纲不同领域和主题的知识和理解。
课程大纲
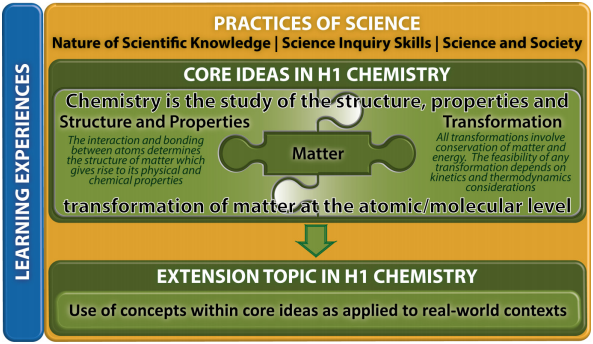
核心理念1——物质
1.原子结构
原子核:中子、质子、同位素、质子和核子数
电子:电子能级,电离能量,原子轨道,核外结构
核心理念2-结构和属性
2.化学键接:离子键、金属键、共价键和配位共价键、简单分子的形状和键角、键极性和分子极性、分子间力,包括氢键、键能和键长、固体的晶格结构、粘合和物理性能。
3.酸和碱的理论:阿伦尼乌斯和布朗斯特德-劳里酸碱理论、酸离解常数Ka、碱基解离常数Kb、水的离子积Kw、pH:指标的选择、缓冲溶液。
4.元素周期表:元素的原子和物理性质的周期性、第三周期元素化学性质的周期性、第1组和第17组元素化学性质的周期性。
核心理念3-转型
5.摩尔概念和化学计量:原子和分子的相对质量、摩尔,阿伏伽德罗常数、经验公式和分子式的计算、(溶液和气体的)反应质量和体积、氧化还原过程:电子转移和氧化数(氧化态)的变化。
6.化学能量学-热化学:焓变、燃烧、中和、键能、晶格能、赫斯定律。
7.反应动力学:简单的速率方程;反应的顺序;速率常数、活化能的概念、浓度、温度和催化剂对反应速率的影响、多相催化剂、酶作为生物催化剂。
8.化学平衡:可逆反应、动力平衡。
扩展主题-材料
9.1纳米材料:纳米材料和纳米粒子、多相催化、石墨烯的结构和性能。
9.2聚合物:经验公式、分子公式和结构式、官能团与有机化合物的命名、有机反应的常用术语、异构:宪法(结构)、有机分子的形状、烷烃、卤代烷烃、醛类、酮、醇类、燃烧、消除、羧酸、聚合物的结构和用途。
考试内容
试卷1(1小时,30分)
这份试卷由30道选择题组成。五到八个项目将是多重完成类型。所有问题将包括4个选项。
试卷2(2小时,75分)
本文由数量可变的结构化问题组成,包括基于数据的问题。所有问题都是必修的,并在试卷上回答。基于数据的问题占本试卷的20-25分。基于数据的问题为测试高阶思维技能(如处理、应用和评估信息)提供了良好的机会。有些题还会要求考生综合化学教学大纲不同领域、不同题目的知识和理解。
试卷3(2小时,80分)
本文由两部分组成,A部分60分,由3-4道自由答题组成,全部为必修。每个问题占15-25分。B部分20分,包括两个问题,每个问题20分。考生要回答任何一个问题。这些问题将要求考生整合化学教学大纲不同领域和主题的知识和理解。
试卷4(2小时30分钟,55分)
本文将在以下技能领域评估目标C1至C5的适当方面:规划(P)、操纵、测量和观察(MMO)、数据和观察结果的列报(PDO)、分析、结论和评估(ACE)。
规划(P)的评估权重为5%。技能领域MMO、PDO和ACE的评估将占15%的权重。实践试卷的范围在实践评估部分有所说明。PDO和ACE的评估还可能包括不需要实际设备和仪器的数据分析问题。在评估过程中,考生不得查阅书本和实验笔记本。
课程大纲
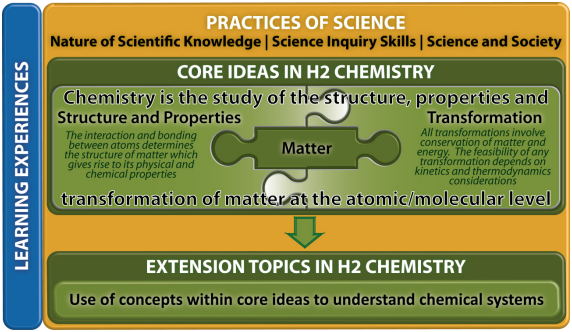
核心理念1——物质
1.原子结构
原子核:中子、质子、同位素、质子和核子数
电子:电子能级,电离能量,原子轨道,核外结构
核心理念2-结构和属性
2.化学键接:简单分子的离子键、金属键、共价键和配位键的形状和键角、键极性和分子极性、分子间力,包括氢键、键能和键长、固体的晶格结构、粘合和物理性能。
3.气态:理想气体行为及其偏差、pV=nRT及其在确定M值中的应用、道尔顿定律及其在确定混合物中气体分压中的应用。
4.酸和碱的理论:阿伦尼乌斯、布朗斯特德-劳里和刘易斯的酸碱理论
5.元素周期表:元素的原子和物理性质的周期性、在第三周期(钠到氯)和以下组(第2组和第17组)中质子数的变化、第三周期元素化学性质的周期性、第2组和第17组以下元素化学性质的周期性。
核心理念3-转型
6.摩尔概念和化学计量:原子和分子的相对质量、摩尔,阿伏伽德罗常数、经验公式和分子式的计算、(溶液和气体的)反应质量和体积。
7.化学能量学-热化学和热力学(吉布斯自由能和熵):焓变、燃烧、水合作用、中和、雾化、键能、晶格能、电子亲合性、赫斯定律,包括波恩-哈伯循环、熵和自由能。
8.反应动力学:简单的速率方程;反应的顺序;速率常数、活化能的概念、浓度、温度和催化剂对反应速率的影响、均相和多相催化、酶作为生物催化剂。
9.化学平衡:可逆反应、动力平衡
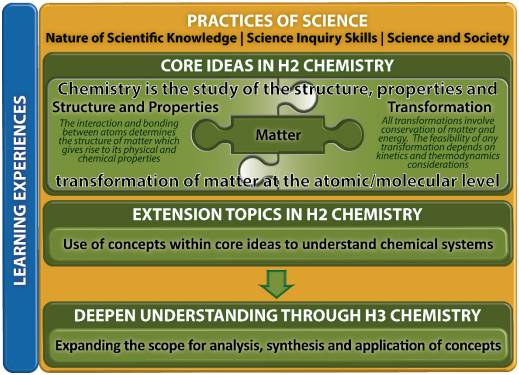
扩展主题
10.水溶液化学
10.1酸碱平衡:酸离解常数、Ka和pKa的使用、碱离解常数Ks和pKs的使用水的离子产物KwpH:pH指示剂的选择、缓冲溶液。
10.2溶解度平衡:溶度积;同离子效应和络合离子的形成。
11.有机化学
11.1简介:经验公式、分子公式和结构式、官能团与有机化合物的命名、有机反应和反应性的常用术语有机分子的形状;ơ和元结合。
11.2异构现象:异构:宪法(结构);顺反式;对映异构。
11.3碳氢化合物:烷烃、还原和氧化反应、芳烃、亲电取代反应。
11.4卤素衍生物:卤代烷烃、亲核取代、卤代芳烃碳-卤键不反应性的相对强度。
11.5羟基化合物:醇(以乙醇为例)、三碘甲烷测试酚。
11.6羰基化合物:醛(以乙醛为例)、酮(以丙酮和苯丙酮为例)。
11.7羧酸及其衍生物:羧酸(以乙酸和苯甲酸为例)、酰氯(以乙酰氯为例)、酯(以乙酸乙酯和苯甲酸苯酯为例)。
11.8氮化合物:胺、苯胺酰胺的其他反应、氨基酸、蛋白质。
12.电化学:氧化还原过程:电子转移和氧化数(氧化态)的变化、电极电势、电池和燃料电池、电解。
13.过渡元素化学导论:第一组过渡元素钛到铜的一般物理和特征化学性质、复合体的颜色
考试内容
考生将参加2小时30分钟的试卷(总分100分)。本论文由两部分组成,将包括要求考生整合教学大纲中不同部分的知识和理解的问题。
A部分(60分):本部分将包括数量可变的强制性自由回答问题,包括1到2个基于刺激的问题。基于刺激的问题构成了这篇论文的15-20分。
B部分(40分):考生将被要求回答三个自由回答问题中的两个。每道题20分。
课程大纲
1光谱技术
1.1光谱学的基本原理:分子轨道理论、电磁波谱、能量的量子化、能级跃迁。
1.2紫外/可见光谱:电子跃迁、生色团、摩尔吸光系数和比尔-朗伯定律。
1.3红外光谱:分子振动:拉伸和弯曲、特征红外吸收。
1.4核磁共振光谱:核自旋和能量吸收、化学位移、内部参考,电负性效应,各向异性效应,氢键、峰面积计算和质子计数、自旋-自旋分裂。
1.5质谱分析:电离、分裂和质荷比、光谱解释:分子离子峰,同位素丰度,碎片离子。
2、进一步的有机机制
2.1分子立体化学:立体化学投影、异构:构象,顺反,对映异构,非对映异构。
2.2基础物理有机化学:动力学和热力学控制:哈蒙德公设,贝尔-埃文斯-波兰尼原理计算,涉及反应的活化能和焓变。
2.3亲核取代:机理:亲核试剂和离去基团的性质,SN1,SN2、机制动力学:能量分布,速率定律,简单速率方程式,反应级数,速率常数,立体化学,取代基效应、SN1和SN2之间的竞争。
2.4消除:机制顺/反消除,立体选择性,区域选择性,E1,E2、机制动力学:能量分布,速率定律,区域选择性、E2/SN2竞争:底物效应、基础效应。
以上就是有关新加坡A水准化学考试的全部介绍啦,希望对大家有帮助。考而思惟世是专业的新加坡A水准考试辅导机构,15年教学经验,大家有相关的问题或者是辅导需求的,都可以随时在线咨询哦~
凡来源标注“惟世教育”均为惟世教育原创文章,版权均属惟世教育所有,任何媒体、网站或个人未经本网协议授权不得转载 链接、转贴或以其他任何方式复制、发表。未注明来源等稿件均为转载稿,如涉及版权请联系在线客服处理。
免费获得学习规划方案
已有 2563 位留学生获得学习规划方案



马上领取规划
*已对您的信息加密,保障信息安全。

 在线咨询
在线咨询
 免费通话
免费通话